Imaginez vous en train de vous balader paisiblement en forêt. Il fait assez bon, l’air est doux et vous vous prêtez au jeu de l’exploration. Au détour d’un sentier, vous tombez sur un petit étang caché qui semble a priori calme. Les étangs sont assez marrants et vous décidez d’aller y jeter un coup d’oeil. En se rapprochant du bord, un spectacle surprenant attire votre attention : une étrange valse de tout petits insectes glissant sans effort à la surface de l’eau !
Rassurez-vous, vous ne rêvez pas, et ce n’est ni un miracle ni la magie des bois. En réalité, cet apparent exploit est dû à un phénomène physique bien connu : la tension superficielle.
Vous ne le savez pas encore mais l’insecte que vous avez rencontré est un gerris. Ce funambule a su tirer profit de cette force afin d’en faire un moyen de locomotion original. Pourtant, la tension superficielle façonne largement notre vie quotidienne : des gouttes de pluie aux bulles de savon !
Essayons d’examiner cela d’un peu plus près !
Pourquoi les gouttes de pluie sont-elles sphériques ?
Nous le savons depuis notre enfance : il existe trois états fondamentaux de la matière (les plus chanceux d’entre vous savent qu’il y’en a en réalité quatre mais ne nous emballons pas). Il s’agit des : liquides, solides et gaz.
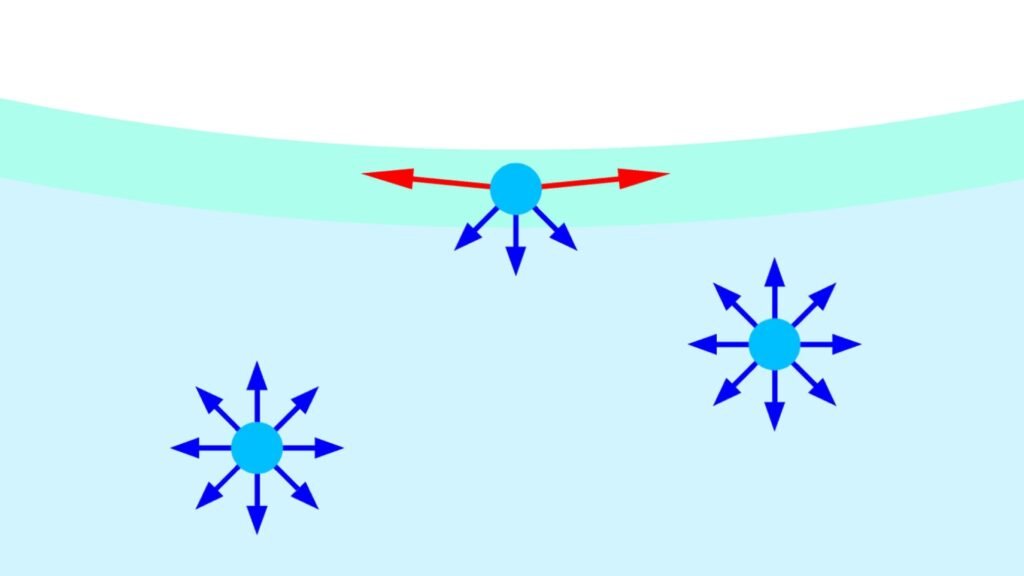
Dans les phases dites condensées (solides et liquides), les molécules s’attirent mutuellement. Plus spécifiquement, on dira qu’elles sont soumises à des forces cohésives ou à des interactions attractives avec leurs voisines.
Celles-ci sont essentiellement de deux types :
- Les forces de Van der Waals (dominantes pour les huiles).
- Les liaisons hydrogènes (dominantes dans l’eau).
Au sein d’un liquide, toutes ces forces s’équilibrent et les molécules sont dans un état satisfait. À la surface, c’est une toute autre histoire car la résultante des forces appliquées n’est plus nulle : elle est dirigée vers l’intérieur du liquide. Les molécules sont insatisfaites.
C’est ce phénomène qui est à l’origine de l’émergence de la tension de surface du liquide. Pour résumer, on peut distinguer deux zones distinctes qui caractérisent chaque liquide :
- L’intérieur du liquide : dans lequel l’ensemble des molécules sont épanouies en étant soumises à des forces qui se compensent entièrement 🙂.
- La surface : où les molécules sont contrariées car elles perdent la moitié de leur attractions cohésives ☹️.
Et c’est cette dichotomie qui pousse les liquides à tenter d’ajuster perpétuellement leur interface : le but étant de minimiser leur surface afin d’en exposer le moins possible.

Vous l’aurez donc deviné, l’une des formes universellement connue qui soit la plus compacte possible afin de remplir ce critère de minimisation de surface est la sphère.
Celle-ci est bien pratique car elle dispose de la plus petite surface pour un volume donné : le rapport surface/volume étant le plus faible possible !
À vos fouets : mayonnaise en vue !
C’est bien connu : l’eau et l’huile ne se mélangent pas. Pourtant, ces deux ingrédients sont essentiels afin d’en faire une mayonnaise, par exemple. Alors comment s’y prendre pour remédier à ce manque d’affinité ?
Ça tombe bien : la tension de surface va aussi nous permettre de faire de la cuisine !

En étant séparées, l’eau (contenue dans le jaune d’oeuf) et l’huile disposent d’une interface qui est minimale. Les molécules des deux phases se boudent et chacune a plutôt tendance à rester de son côté en raison de la très forte tension de surface présente à la surface de contact entre les liquides.
Afin de « briser » cet état naturel, il est important d’introduire une énergie mécanique afin de créer davantage de surface : on émulsionne.
Ces coups de fouet vigoureux disposent d’un double avantage :
- D’une part, en créant un grand nombre de gouttelettes d’eau qui viennent se mélanger à l’huile, la surface totale de contact augmente drastiquement.
- D’autre part, en remuant le jaune d’oeuf, on libère des émulsifiants qui abaissent la tension de surface et permettent de stabiliser les gouttelettes d’eau fraichement générées (on en parlera un peu plus tard).
Ainsi, nous avons vu que pour déformer le liquide et en augmenter la surface, il est essentiel d’introduire une énergie supplémentaire. Dans le cas de la mayonnaise, il s’agit d’une énergie mécanique (fouet). En effet, il est primordial de lutter contre la force de tension superficielle qui s’opposera toujours à cette augmentation. Oui, la tension de surface est comme votre patron : elle vous refusera toujours toute augmentation…
Disons que l’on veut augmenter une surface S d’une petite quantité notée dS. L’énergie à apporter doit être proportionnelle à la quantité de molécules qu’il faut transporter à l’interface, et donc à dS. On note alors la relation :
\[\delta E=\gamma \delta S\]Le coefficient de proportionnalité entre l’énergie dE et la surface dS est ce qui est appelé le coefficient de tension de surface. Autrement dit, on peut également comprendre la tension superficielle d’un point de vue énergétique. C’est la quantité d’énergie dE à apporter à un système afin d’en augmenter la surface d’une unité dS.
Les secrets du gerris, le funambule des eaux
Et le gerris dans tout ça : comment fait-il pour patiner sur l’eau ? Encore une question de tension !
On vient de le voir : les molécules à la surface d’un liquide n’ont rien au-dessus de la tête. Afin d’assurer leur cohésion, cette absence de voisins fait que la tension superficielle y est très élevée ! Les molécules sont donc très attirées vers l’intérieur du liquide. L’interface de l’eau se comporte alors comme une très fine membrane élastique que l’on peut déformer avec précaution. C’est cela qui permet au gerris de marcher sur l’eau.

Cette « punaise des eaux » parvient à patiner à la surface des étangs car elle est suffisamment légère afin de ne pas briser la membrane présente à l’interface de l’eau. À cela s’ajoute, des poils microscopiques et hydrophobes situés à l’extrémité de leurs pattes, et vous vous retrouvez donc avec un insecte étonnant qui semble défier les lois de la physique alors qu’il n’en fait que tirer partie !
La tension de surface vous rendra plus propre !
En préparant notre mayonnaise, on a parlé d’émulsifiants contenus dans le jaune d’oeuf. Mais de quoi s’agit-il au juste ?
Un émulsifiant est un composé qui permet de modifier la propriété de certains liquides en abaissant leur tension de surface : On parle alors de surfactants ou d’agents tensioactifs.
Dans le cas de la mayonnaise, il a fallu générer des gouttelettes d’eau et les maintenir dans l’huile sous forme d’émulsion. Pour cela, il est essentiel d’abaisser drastiquement la tension de surface afin que ces gouttes ne fusionnent pas entre elles. L’émulsifiant est un surfactant mais il n’est pas le seul : les détergents et lessives sont également des agents tensioactifs.
Plus spécifiquement, les molécules tensioactives ont une structure en deux parties :
- Une tête dite hydrophile : cette partie adore l’eau et se lie aisément à ses molécules.
- Une queue dite hydrophobe : c’est tout le contraire de la tête et se lie surtout aux molécules d’huile et de graisse.
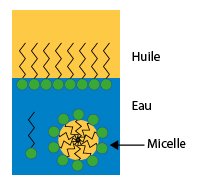
En introduisant de la lessive dans l’eau, les tensioactifs se répandent dans l’ensemble de la solution aqueuse. La partie hydrophobe de ces molécules va se fixer sur les taches de gras et va permettre à l’eau de se diffuser efficacement afin d’évacuer les saletés.
Ceci est rendu possible par la formation de petits agrégats de gras entourés de tensioactifs que l’on appelle micelles.
Ces produits permettent donc d’abaisser la tension superficielle afin de mouiller davantage les vêtements et de dissoudre convenablement les salissures.
Goutte à goutte : la méthode du stalagmomètre
Il existe une grande variété de méthodes envisageables afin de mesurer la tension superficielle d’un liquide. Dans le domaine industriel, cette mesure est assez sensible et le protocole expérimental afin de l’obtenir doit être rigoureux. Mais nous ne sommes pas aussi contraints et nous allons voir qu’une méthode assez accessible peut tout aussi bien fonctionner.

Imaginons un jeu où chaque goutte compte : c’est le principe de la méthode dite du stalagmomètre (on parle alors de stalagmométrie). Comment ça marche ?
Le stalagmomètre est un outil ingénieusement simple : il s’agit d’un tube assez fin doté d’une ouverture suffisamment petite afin de laisser s’écouler un liquide goutte à goutte. Ces gouttes ne doivent pas leurs formes au hasard. Nous l’avons vu : le liquide doit s’accommoder de la tension de surface afin de décrire une interface quasi-sphérique. Dans le cas d’un chapelet de gouttes tombantes, celles-ci sont le fruit d’un équilibre subtil entre la gravité (qui les force par le bas) et la tension superficielle (qui veut résister à l’appel du vide).
Mais quel est le rapport ?
Eh bien, le but est simplement de compter le nombre de gouttes qui se sont formées à partir d’un volume donné de liquide. Ce nombre dépend totalement de la tension de surface ! En effet, plus celle-ci est forte, moins la goutte sera tentée de se laisser tomber. Inversement, un liquide à faible tension de surface formera un plus grand nombre de gouttes.

Pour les initiés, c’est la loi de Tate (pas les frères) qui permet de mesurer la valeur du coefficient de tension superficielle. Plus précisément, cette loi établit une relation entre masse et tension de surface des gouttes.
En pratique ?
On doit se servir d’un liquide étalon. Le but étant de commencer par mesurer la masse totale d’un certain nombre de gouttes obtenues avec un volume de liquide dont la tension superficielle est connue. On déduit donc la masse d’une goutte.
On fait de même avec le liquide cible : on pèse un certain nombre de gouttes et on en déduit leurs masses.
La loi de Tate permet de finir le travail et de déterminer la valeur souhaitée :
\[\gamma = \gamma_0 \frac{m}{m_0}\]Cette méthode est à la fois élégante et facile à mettre en place mais attention : chaque goutte comptera !
En conclusion
Nous avons vu que la tension de surface pouvait expliquer un grand de phénomènes fascinants et différents. Pourtant, ses implications peuvent aller encore bien au-delà de nos attentes !

En effet, savez-vous qu’il est également possible de se propulser grâce à la tension superficielle ? À la lumière du gerris, certains insectes ont été capables de se propulser à la surface de l’eau avec une vitesse avoisinant les 20 cm/s ! C’est le cas, par exemple, d’un micro-organisme aquatique nommé microvelia. Son déplacement est dû à la libération de tensioactifs dans l’eau qui lui permet de se déplacer sans même nager !
Ce type de phénomène porte un nom en physique : c’est l’effet Marangoni mais ça, ça sera pour une autre fois !